台湾生技制药产业发展综述
鲁小兵 阎桂兰
随着全球经济持续增长、人口结构高龄化趋势、各国和地区新药上市数量增加,以及因为生活水准提高,重大疾病年轻化与病患数增加等因素,使得全球药品市场规模持续增长。依据IMS Health公司统计,2012年全球药品市场规模达到9590亿美元,约比2011年增长2.4%,但增长幅度却创下近年新低,如图1所示。

图1 全球药品市场规模
资料来源:IMS Health Market Prognosis,June 2013。
全球药品市场现况
分析全球各区域药品市场规模,北美与欧洲地区为全球主要药品市场。2012年北美地区药品市场规模为3490亿美元,欧洲地区药品市场规模为2243亿美元,分占全球药品市场规模的36.4%与23.4%,两者合计占全球药品市场规模的59.8%,但与以往相比,市占率已有显着的下降。2012年日本药品市场规模为1105亿美元,占全球药品市场规模的11.5%;非洲、大洋洲与不包括日本在内的亚洲国家,药品市场规模为1681亿美元,拉丁美洲国家药品市场规模也达686亿美元,两者分占全球药品市场规模的17.5%与7.1%。
北美地区和欧洲地区为全球重要专利药销售地区,以中国大陆为主的新兴经济体则以学名药居多。近年随着畅销专利药的专利保护期届满,受学名药抢占市场以及各国政府推动扩大学名药使用政策的影响,北美地区与欧洲地区药品销售额已渐有转变,2012年分别衰退1%与1.8%。以学名药为主的药品新兴市场,由于专利药所占比例不高,受影响程度相对轻微,且学名药市场持续扩大,推升药品市场的增长。2012年非洲、大洋洲与不包括日本在内的亚洲国家与拉丁美洲国家和地区分别增长12.8%与10.9%,如表1所示。
表1 2012年全球药品市场区域分布
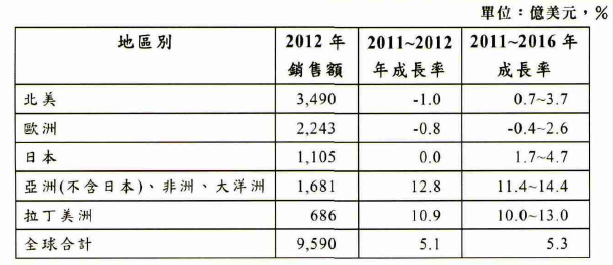
资料来源:IMS Health Market Prognosis,June 2013。
依治疗领域区分,2013年癌症药物为全球销售额最高的治疗用药,销售额达到671.32亿美元,约比2012年增长8.5%。由于癌症种类众多,且病患数快速增加,药品也属昂贵标靶药物等,致使癌症用药销售额高居不下。疼痛疾病用药(Pain)、糖尿病用药(Antidiabetics)则分居第2名和第3名,销售额分别为572.93亿美元和543.69亿美元。另外,皮肤用药(Dermatologics)首次进入前十大治疗用药之列,位居第10名,2013年销售金额达267.78亿美元,增长11.3%,如表2所示。
表2 2013年全球前十大治疗药分类领域
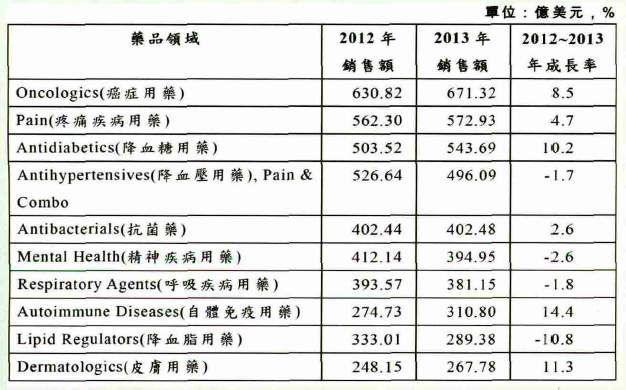
资料来源:IMS Health Market Prognosis,June 2013。
前十大治疗用药中,共有6种治疗用药持续增长,其中又以自体免疫用药增长最快,2013年销售额达310.8亿美元,增长14.4%。此类疾病用药多属高单价的生技药品,且部分药品已成为畅销药,例如Humira、Enbrel、Remicade等药品,带动此类药品销售额快速增长。降血压、精神疾病、呼吸疾病及降血脂等4种用药的销售额则呈现衰退。
随着全球经济持续增长,以及各国医疗保健政策陆续推动,例如美国自2014年1月开始实施《病患保护与平价医疗法案》,将针对部分所得收入民众提供优惠补助,鼓励参加医疗保险,提高医疗保险覆盖率。日本政府预计随着高龄化社会到来将增加对药品需求,推动至2018年,使用学名药的比例须达到60%,将使学名药的使用增加一倍。欧洲国家也通过药价调整措施,扩大学名药的使用,降低医疗支出。另外,中国大陆与印度尼西亚也将提高医疗保险的覆盖率,扩大医疗保险对象。随着各国扩大保险对象及增加处方笺的学名药使用比例等措施的落实,将持续推升全球药品市场增长。
依据IMS Health公司的预测,全球药品市场增长率将由2013年的2%至3%提高至2017年的5%至7%,2017年全球药品市场规模将达到1.2万亿美元。其中美国为最大药品市场,约占全球药品市场的31%。中国大陆若将传统中草药纳入,其将占全球药品市场的15%,日本则占11%。另外,法国、德国、意大利、西班牙和英国等欧盟5国也占13%,巴西、俄罗斯和印度的制药市场合计约占8%,新兴国家和地区则占有10%。
此外,IMS Health公司也预测未来5年,每年将有35个新药核准上市,将以罕见疾病和小群体患者为主的药品居多,包括类风湿关节炎、纤维化囊肿和癌症等未满足医疗需求的药品。另外,部分地区性盛行的治疗药品,包括疟疾、新生儿败血症和结核病也可能成为厂商未来规划投入的新品项。
以下分别针对生技药品、学名药及生物相似性药品等市场发展现况扼要陈述。
生技药品市场
生技药品是指应用基因工程技术,利用动植物及微生物等生物体生产出来的药物,用于疾病的治疗、诊断及预防。生技药品分子结构较小分子药复杂,生产成本也高,但其对疾病治疗具有专一性,尤其对肝病、癌症及后天免疫缺乏症候群(AIDS)等难以治愈的重大疾病更具疗效。因此,生技药品从核准上市后到成为全球畅销药品,平均销售期快于小分子新药。另外,小分子药品在专利保护期届满后,立即有学名药与之竞争,致使销售额大幅下降。生技药品由于结构复杂,复制不易,且生物相似性药品开发成本也远比学名药高,因此即使专利保护期届满,产品价格下降幅度仍低于学名药。基于上述优势,已吸引许多企业投入生技药品开发。
近年来,全球各种疾病罹患数快速增加,尤其癌症、糖尿病等病患人数增长快速,该类疾病的治疗用药多属生技药品,带动全球生技药品市场的快速增长。依据IMS Health公司统计,2012年全球生技药品市场规模为1690亿美元,不仅较2011年增长7.6%,生技药品占全球药品市场的比重也达18%。另外,按市场别区分,美国为全球最大生技药品市场,约占全球生技药品市场的48.6%。其次为欧洲市场,销售额占全球生技药品市场的21.6%。日本市场也占有9.1%,美国、欧洲和日本三大市场的生技药品销售额即占全球生技药品市场的79.3%。相对而言,新兴市场国家和地区的生技药品销售额仅占全球生技药品市场的7.5%,比重相对偏低。显示现阶段生技药品市场的增长仍由发达国家带动,与全球药品市场增长来自于药品新兴市场所有不同。
生技药品的发展与技术持续精进有关,治疗领域也由以往的红血球生成素(EPO)转而以抗体治疗药物为主。全球抗体治疗药物占生技药品市场规模已由2006年的34.5%增加至2012年的51.8%,红血球生成素的销售额则降至第6名。另外,每年销售额超过10亿美元的生技药品数量也从2006年的20个增加到2012年的33个,显示生技药品市场的快速增长。
随着全球对生技药品的使用持续增加,以及产品不断的核准上市,全球生技药品市场规模将持续增长。依据IMS Health公司预测,2017年全球生技药品市场规模将达到2210亿美元,并占全球药品市场的19%~20%,由于市场高度增长,预期将吸引更多企业投入生技药品开发。
学名药市场
学名药是指企业以原开发厂的小分子专利药为参考药品,其在用途、剂型、安全性、疗效与给药途径、品质与药效特性上应完全相同或具有生物相等性。由于学名药多采用合成方式生产,制程不像原厂药那么繁琐,使得可投入学名药开发企业众多。此外,美国食品药物管理局对于第一个上市的学名药可给予180天的独卖权,且价格约为原厂药的80%,其庞大利润吸引学名药厂争相投入第一个学名药的开发。至于其后核准上市的学名药,其价格将随着同产品上市数量增加,面临市场竞争而大幅下降。预计2017年全球学名药市场占全球药品市场的比例将提高至36%,其中药品新兴市场的学名药市场占有率更达到63%,并将成为全球学名药市场增长的主力。
生物相似性药品市场
生物相似性药品是企业以专利即将届满的生技药品作为药品开发的参考标的,但生技药品因结构复杂,企业参考标的物开发的产品,因为无法证明两者分子特性完全相同,仅能称相似。
生物相似性药品开发与学名药大为不同,在于小分子药品多以化学合成方式进行,分子结构相对简单与稳定;生物相似性药品则为大分子药品,分子结构复杂且不稳定,每批次生产可能不相等,而无法依循学名药的审查模式,需另有专法规范,因此生物相似性药品上市难度较学名药要高。同时,生物相似性药品开发经费更甚于学名药,也提高了进入门槛,因此投入生物相似性药品开发的企业也不像学名药企业那么多,产品价格也不易大幅下降。
鉴于全球生技药品市场快速增长,数种畅销生技药品专利将于未来几年届满。依据生物资讯机构以2012年生技药品销售额为基础,至2022年专利届满的生技药品,市场规模达到1250亿美元,引爆生物相似性药品的市场商机。各国为加速生物相似性药品开发,纷纷制定审查规范,以利企业开发时有所遵循。迄今全球已有22个国家和地区与组织颁布生物相似性药品的审查准则,其中欧盟、澳大利亚、日本、加拿大与美国在内的全球主要药品市场,对于生物相似性药品的开发已有完善的审查规范,台湾也于2008年公布《药品查验登记审查准则-生物相似性药品之查验登记》。自从欧盟于2006年首次核准生物相似性药品上市以来,已有加拿大、澳洲、日本、韩国、印度等国家相继核准生物相似性药品上市。
依据欧盟药监局统计,至2014年1月底,欧盟药监局已核准20个生物相似性药品,其中2个产品撤销上市,共有18个生物相似性药品在欧盟上市销售,包含首次核准由韩国Celltrion公司开发的单株抗体生物相似性药品Remsima。在亚太地区,澳大利亚共核准8个生物相似性药品,日本和韩国分别核准5个和2个,台湾也核准1个上市。印度已核准上市的56个生技药品中,多为印度企业依据国外已上市的生技药品进行研发生产,故性质上也属于生物相似性药品。
依据Frost & Sullivan公司的研究报告显示,2013年全球生物相似性药品市场规模约为12亿美元,欧洲为全球生物相似性药品最大市场,其次为亚洲地区。从事生物相似性药品开发的企业涵盖学名药公司及生技药品公司,其中Sandoz公司在全球生物相似性药品市占率达到50%。Amgen公司和Waston公司以癌症药物Herceptin为参考药品,开发生物相似性药品。EliLilly公司以糖尿病用药Lantus作为参考药品,开发生物相似性药品。Merck公司则以Enbrel和Neulasta等生技药品作为参考药品,从事生物相似性药品的开发。另外,Teva公司与Mylan公司也投入生物相似性药品的开发。
未来随着生技药品专利届满及法规更加完备,预期将有更多生物相似性药品核准上市。同时,生物相似性药品在美国、日本及新兴药品市场的渗透度提高,也将带动全球生物相似性药品的快速发展。依据Frost & Sullivan公司预估,2019年全球生物相似性药品市场规模将达到230亿美元。
台湾西药制剂产业
台湾制药产业包括西药制剂(成药)、原料药、中草药及生物制剂等领域,其中西药制剂规模最大,但原料药近年也持续向上攀升,中草药及生物制剂规模相对较小。
西药制剂是指将具有活性成分的原料药,经加工制成不同剂型或剂量,且具有疗效的小分子药品。西药制剂又可依专利保护与否,区分为具有专利的新药,或是依据已超过专利保护期的原厂药成分或制造方式进行开发的学名药。
为确保药品品质,台湾“卫生署”(现名“卫生福利部”或“卫福部”)于1982年颁布优良药品制造标准(简称GMP),开始推动实施药厂GMP制度。药厂需通过GMP查厂,取得药品制造许可方能从事药品生产。其后,根据国际发展趋势,于2015年1月全面实施cGMP与国际医药品稽查协约组织PIC/SGMP规范,使台湾药品质量能够达到国际标准。截至2014年6月底,台湾已有141家西药制剂厂获得cGMP制度认可,其中有67家药厂通过PIC/SGMP制度评测,有利于扩大台湾西药制剂外销市场。
2013年台湾西药制剂出口金额达到新台币114亿元,中国大陆为台湾西药制剂最大出口目的地,出口金额为新台币19.16亿元,其中以抗生素制剂出口为主,出口金额为新台币12.3亿元;美国、澳大利亚、日本、越南分别占据台湾西药制剂出口排名的第2-5名, 如表3所示。
表3 2013年台湾西药制剂前十大进出口来源地和目的地

资料来源:财团法人医药工业技术发展中心。
台湾已有许多企业投入于小分子新药研发,其中太景生技公司治疗社区性肺炎的抗生素新药“奈诺沙星”口服剂型已通过台湾“卫福部食品药物管理署”审查,成功取得岛内小分子新药药证,开启岛内新药上市首例。同时,太景生技公司已向中国大陆食品药品监督总局申请上市许可。另外,宝龄富锦公司研发的肾脏病新药Nephoxil,经授权日本Tobacco制药公司,也成功取得日本厚生省核发的新药制造与销售许可。
目前,岛内小分子新药开发也有部分产品已进入后期阶段,例如智擎生技公司与授权伙伴美国Merrimack制药公司合作的抗胰脏癌新药MM-398,目前三期临床试验进展顺利。基亚生技公司研发的抗肝癌新药PI-88已完成三期临床试验,正在进行期中分析,其结果将作为是否进一步开展期末分析或直接申请药证的依据。晟邦公司正在开发中的长效止痛针剂也完成三期临床试验,将申请药品查验登记。另外,晟德公司在英国进行的抗丛发性头痛药品二期临床试验也临近结束。
岛内还有许多小分子候选药品获得阶段性进展,进入早期临床试验阶段,包括台湾微脂体公司用于治疗黄斑部病变新剂型新药ProDex与心悦生医公司研发的精神分裂症新药SND-1皆通过美国食品药物管理局(FDA)的初始审查,将进入一期临床试验。智擎生技公司与美国Merrimack制药公司合作研发的MM-398合并药物Cyclophosphamide,用于治疗儿童伊文斯(Erwing’s)肉瘤,已在美国开展一期临床试验。另外,台大医院与Johnson & Johnson公司共同合作开发的B肝用药,将由台大医院负责动物试验等临床前开发,以及后续在岛内执行临床试验事宜。
台湾企业除自行开发新药,也经由技术转让承接海外技术,进行后续新药研发。如药华医药公司取得美国Kinex制药公司用于抗癌药物开发的口服紫杉醇Oraxol和口服喜树碱Oratecan技术,经由口服可让药效浓度平稳上升而且能维持较久,减低在病人身上的副作用,将在台湾、新加坡进行后续新药开发。台湾东洋公司取得日本大鹏药品公司技术授权进行开发的胃癌辅助性治疗口服用药TS-1,已通过台湾“卫福部”审查,将原本作为胃癌病人辅助性治疗标准用药扩大于治疗局部晚期或转移性胰脏癌病人的新适应症。
由于学名药多采取合成方式进行,制程不像原厂药那么繁琐,导致参与学名药开发企业众多而引发价格竞争。为维持优势,岛内部分学名药企业将开发目标转向技术门槛较高的特殊剂型或特色学名药,并依循第四类学名药(简称P4)审查规定,提出简化新药申请(ANDA),挑战原厂专利。例如安成国际药业公司研发的9项特殊学名药,有一多半采用P4模式,其中治疗高血压、心绞痛的学名药Nifedipine Extended-Release Tablets已通过美国食品药物管理局审查,取得药证。法德生技药品公司的长效抗精神分裂症学名药Quetiapine Fumarate也已向美国食品药物管理局申请简化新药申请。美时制药公司的减肥药“罗氏鲜”已进入美国食品药物管理局实质查验登记及欧盟药监局后续审查阶段。此外,美时制药公司也引进美国学名药厂Alvogen公司的策略性投资,同时将并入Alvogen公司,并打造成为其在亚太地区的营运总部。
由于台湾药品市场规模小,且全球各国和地区都在积极扩大学名药的使用,有利于台湾学名药企业拓展海外市场,因而岛内企业正在积极运用并购、取得外国药证及授权等方式进行市场布局。其中,永信药品公司并购日本Chemix公司,将结合其优势,朝向针剂、抗肿瘤药品等领域发展,并争取全球庞大的学名药商机;该公司现已取得美国嗜睡症、抗生素及心血管用药等3张药证,以及中国大陆市场的消炎止痛针剂及降血糖复方等两张新药证,可望带动外销市场的增长。同时,永信药品公司工厂也通过英国药品和医疗产品管理中心(MHRA)的查厂,成为符合美日欧等主要发达国家的高规格生产基地。
台湾中化制药公司与安成国际药业公司合作开发的降血压特殊剂型学名药,已完成美国食品药物管理局查厂;与子公司中化合成生技公司合作的免疫制剂系列Tacrolimus,也已向美国食品药物管理局申请查验登记,希望能抢占美国市场商机。另外,中化制药公司在Novartis公司的血液肿瘤用药Gleevec与乙肝治疗用药“贝乐克”专利期届满后,已顺利取得岛内学名药药证。
健亚生技公司与台湾神隆公司结合各自在原料药制程与制剂配方的优势,共同开发口服治疗乙型肝炎的学名药“利甘平”,日前已取得台湾“卫福部”核发的药证,将抢占岛内市场商机,并布局中国大陆市场。另外,健亚生技公司承接台湾“国卫院”的糖尿病新药DBRP108,也将与大陆石药集团合作,共同开发大陆市场。
台湾微脂体公司将治疗全身性霉菌感染药物AmBiL在欧洲与美国的市场经销权授权Sandoz公司,通过其网络营销,将AmBiL推进欧洲与美国市场,韩国市场则授权给韩国SCD公司进行销售。由于AmBiL已取得台湾“卫福部”核发的药证,将委托永信药品公司生产,同时负责在台湾地区的销售;乳癌药物“力得”(Lipo-Dox)则授权给台湾东洋公司,抗癌药物“德适舒”(Doxisome),授权给国际大厂Teva公司。另外,治疗周边血管疾病的“普络易”(ProFlow)也授权给韩国伊东公司及美国SciClone制药公司,其中美国SciClone制药公司负责中国大陆、香港及澳门等地的销售。
台湾原料药产业
原料药是指从动植物、微生物、矿物及普通化学品等原材料中,经由物理方式、化学合成、基因工程及组织培养等制程技术,从中取得活性物质或成分,用于西药制剂或生物制剂等产品的制造。
为加强对原料药品质的管理,台湾“卫福部”已推动自愿性原料药GMP评鉴,受理企业申请,并自2013年7月起,分阶段、分品项实施原料药主档案(DMF)管理制度。据统计,岛内目前共有台湾神隆、台耀化学、中化合成、生泰合成、永光化学等18家公司21个药厂通过原料药GMP评鉴,通过品项约149项。另外,截至2013年6月,台湾“卫福部”已通过企业申请核备的DMF共629项,其中申请企业为岛内原料药厂的有174项,约占27.7%。
原料药为近年台湾制药产业增长幅度最快的领域,由于岛内原料药企业经强化产品开发能力,已从价格取胜提升至品质取胜的商业模式,并从委托生产、设计至共同开发,成为外国医药公司重要原料供应商,使得台湾原料药为制药产业中外销比重最高的产业类别。随着原料药企业持续为客户开发新产品,将带动台湾原料药外销增长与产业规模扩大。
依据台湾海关进出口资料统计,2013年台湾原料药进口金额约为新台币55亿元,前五大进口来源地分别为中国大陆、意大利、日本、美国与印度,其中来自于中国大陆的进口金额达到新台币18.68亿元,约占台湾原料药进口金额的34%。中国大陆为低价原料药重要生产地,大陆企业运用发酵与合成技术,开发成高单价原料药,再供应海内外制剂厂使用。来自于美国、日本与意大利的高品质原料药则大多直接用于制剂生产。进口原料药以抗生素为主,约占总进口金额的52.23%,其次为有机化合物。2013年台湾原料药出口金额约新台币41.96亿元。
台湾神隆公司为岛内最大原料药生产企业,2013年在全球注册的DMF共有663项,在美国食品药物管理局登记的有47项,其中22项为抗癌药。2013年台湾神隆公司营业额达到新台币50.88亿元,增长率为11%,主要受惠于癌症针剂及中枢神经的原料药销售增长,尤其以治疗大肠直肠癌的针剂原料药Irinotecan增长显着,对营业额贡献度最高。另外,台湾神隆公司近年积极拓展亚洲市场,其中来自于日本与印度市场的收入已有所增加。随着位于大陆江苏常熟的工厂建成,并已获得4项抗癌与抗病毒原料药的生产许可证,其中1项将申请在大陆上市,将有助于其在大陆市场的拓展。
旭富制药公司专注于特殊原料药及中间体产品,由于帕金森氏症用药中间体PGA和临床试验用药S20/38、非固醇类抗发炎原料药LPF.Na等产品的销售增长,2013年营业额达到新台币12.93亿元。未来随着减肥药Belv iq的原料药和抗忧郁症原料药的陆续上市,将有助于该公司营业额的增长。另外,为进军全球抗癌药物原料药市场,旭富制药公司已进行抗癌原料药的研发及少量生产,商业化量产将由投资成立的旭利安公司负责,计划设立癌症及无菌生产线,扩大在抗癌药物原料药的开发。
中化合成生技公司2013年受到Teva公司自行生产MMF的影响,销售额大幅减少,营业额为新台币10.43亿元,衰退了21%。为提升公司经营绩效,中化合成生技公司与鹏旭公司合作,正在进行抗骨髓癌及皮肤癌等学名药开发。
永光化学公司已有15项原料药产品在市场上销售,主力产品为前列腺素、高血压、心衰竭、帕金森氏症及过敏性结膜炎等原料药,并将规划发展抗癌、免疫系统、神经系统等原料药。其转投资台耀化学公司主力原料药产品为降胆固醇磷酸盐及维生素D衍生物。2013年营业额为新台币24.74亿元,仅减少1.27%,受到降胆固醇磷酸盐系列产品的出货量减少,使得原料药营业额下降,未来随着原料药产能提升与学名药客户取得欧洲学名药药证,将可望带动原料药营业额的增长。
台湾生物制剂产业
生物制剂是运用基因工程等技术进行产品开发,用于疾病的治疗及预防,其产品包括蛋白质药品、生物相似性药品、血液制剂及疫苗等。台湾多年来推动生技医药研究,但迄今仅有疫苗类产品成功上市销售,不过目前投入生技药品开发的企业已有增加的趋势,除了台湾浩鼎、药华医药、中裕新药、联亚生技等生技药品研发公司外,最近基亚生技、友华生技等一些小分子新药开发企业也开始跨入生技药品开发。
例如药华医药公司研发的长效型干扰素P1101,利用长效型高分子链结法专利技术,提高有效成分的纯度,已授权奥地利AOP公司在美国和欧洲地区进行三期临床试验;台湾浩鼎公司的乳癌治疗性疫苗OBI-822/821正在台湾进行二、三期临床试验,同时也在美国和韩国进行二期临床试验。另外,友华生技公司与美国CEL-SCI药厂合作研发专门治疗头颈癌新药Multikine,以及永昕生医公司用于类风湿性关节炎的生物相似性新药TuNEX等皆已进行三期临床试验阶段。
中裕新药公司治疗艾滋病的抗体药物皮下注射新药TMB-355,目前已完成一、二期临床试验期中分析,且委托中国大陆药明康德公司生产的试验用药也获得美国食品药物管理局核准。联亚生技公司用于阿兹海默症治疗性疫苗也获得台湾“食品药物管理署”核准执行二期临床试验。
台湾浩鼎公司治疗卵巢癌疫苗OBI-822则与台北医学大学合作,正在进行二期临床试验。赛德医药公司治疗C型肝炎、A型流感和雅祥生技公司的神经损伤修复新药rhAFGF,皆已进入二期临床试验。
基亚生技公司与日本Oncolys生技公司共同开发的肝癌新药OBP-301,已取得美国、欧盟、日本、中国大陆和韩国等10个国家和地区的专利,完成主要市场专利布局,将可望提升OBP-301商业化的价值。泉盛生技公司研发的抗体新药FB825,是第一个证明能针对细胞外受体上IDR区域进行结合,有效阻断上游B细胞分泌IgE的机制,以达到治疗过敏与气喘等相关疾病的效果,将向美国食品药物管理局申请进行临床试验。此外,醣基生医公司承接台湾“中研院”抗癌疫苗、抗体新药、糖芯片等专利技术,将从事糖类抗癌新药开发。台塑生医公司与联亚生技公司合资成立联合生物制药公司,将从事单株抗体药物的研发,并投资兴建产能达2000升的单株抗体量产工厂,满足产品开发与量产需求。
台湾醣联公司则持续强化与日本企业的合作,包括担任日本三菱瓦斯化学公司蛋白质药厂的技术顾问,合作开发卵巢癌抗体新药GNX101,由台湾醣联公司主导研发及小规模试量产,日本三菱瓦斯化学公司负责后期的量产。另外,台湾醣联公司除将大肠癌新药GNX8授权日本大冢制药公司外,还引进日本大冢制药公司的资金,进一步提升合作关系。
台湾疫苗产业大部分依赖从海外进口疫苗,岛内企业供应比例不高,现阶段主要由国光生技公司协助供应及开发。随着基亚生技公司投入疫苗开发,投资设立疫苗公司及兴建细胞培养疫苗生产工厂,将可望提高台湾产疫苗自制比例,并促进台湾疫苗产业的发展。
国光生技公司研发的流感疫苗已通过中国大陆食品药物管理局核准,同意进行三期临床试验,将委托同属国药集团的大陆生物技术公司代理,待取得中国大陆药证后,由后者负责其在大陆市场的营销,其研发的H7N9疫苗也通过台湾“食品药物管理署”审查,同意进行二期临床试验;另外还取得日本UMN制药公司流感疫苗在台湾与中国大陆的经销权,同时引进具有时间快、成本低及运用范围较广的重组DNA基因工程技术,将据此建立流感疫苗新的产制平台,生产流感疫苗。
基亚生技公司的子公司基亚疫苗公司承接台湾“国卫院”研发的临床前动物实验H7N9流感疫苗相关技术,将投入流感疫苗研发;同时还积极开发肠病毒EV71疫苗、新型流感疫苗,以满足台湾防疫需求。
台湾“中研院”以糖蛋白为基础重新设计流感疫苗,让感染H1N1流感病毒的试验动物能产生抗体的功效,也能用于对抗其它多种流感病毒株,有机会发展成为广效性疫苗的潜力,该技术现已授权OPKO Health公司负责产销。
台湾中草药产业
中草药是已收录于中医药典籍中,并经由炮制、萃取等方式制成具有治疗或预防保健功效的产品,包括散、丸、膏、饮片等。近年来,一些台湾制药企业为便利中草药的使用与推广,依据既有药方萃取中药成分,并加入赋形剂制成浓缩中药,也称“科学中药”,成为台当局推动中草药产业发展的主力项目。
目前,台湾中草药产业在研发、制造、质量管理、人才等方面已建立完善的体系,包括通过GMP查核、制定中药品质检验标准等,学术研究机构研发的成果也大多由企业顺利承接,其中彦臣生技公司的“寿美降脂1”、怀特生技新药公司的“怀特血”、中天生技公司的“化疗漾”及“贺必容”等,皆已经通过“卫福部”审查,取得中药新药或植物新药药证。
岛内正在研发的中药新药尚有一些正在进行二期和三期临床试验,其中德英生技公司研发的治疗皮肤麟状细胞原位癌新药SRT100已在台湾完成三期临床试验,并通过美国食品药物管理局核准的二期临床试验,即将投资建造新厂。泰宗生技公司治疗C型肝炎用药TCM-700C已在台湾完成三期临床试验。怀特生技新药公司治疗原发性血小板低下紫斑症的药物也已在台湾完成二期临床试验,将送台湾“食品药物管理署”审查;该药也通过美国食品药物管理局审查,认定为“孤儿药”(即用于预防、治疗、诊断罕见病的药品,因市场上同类药物很少,因而售价非常昂贵);预防骨质疏松症的“怀特骨宝”也已进入二期临床试验。友霖生技公司的抗帕金森症口水溢流的新药已完成美国食品药物管理局二期临床试验审查。这些都说明台湾企业积累多年经验,已具备承接上游中药、植物新药研发成果进行后续开发的能力。
近年来,不少岛内研究机构与企业开始投入对本土药用植物的研究与开发,例如台湾神隆、永信药品、欣扬生医、达尔文国际生物技术公司等利用生物反应器生产紫杉醇与喜树碱等抗癌药物,已进入量产试验阶段;乔本生医公司用于减轻乳癌患者放射线治疗引发副作用的牛樟芝植物新药JBM-TC4,已分别通过台湾及美国食品药物管理部门核准,正在进行二期临床试验;广兴生技公司承接“农业生技国家型计划”的高氏柴胡保肝活性开发技术已获得林口长庚医院核准,正在合作进行小柴胡汤(含高氏柴胡)的基础药理及人体临床研究。朝阳科技大学从牛樟芝子实体内的天然物中萃取出安卓幸(Antrocin)化学物,该化合物经研究发现对抑制大肠直肠癌、肝癌、肺腺癌及乳癌等癌细胞生长活性有显着效果,将为癌症治疗及预防带来新契机。京冠生技公司利用固态发酵技术,发现一项萃取物具有开发成为治疗异位性皮肤炎植物新药的潜力,其生化指标中组织胺及发炎激素IgE皆比类固醇药物还低,效果更优于类固醇药物,将投入治疗异位性皮肤炎及促进伤口愈合植物新药开发。
岛内中医院医师也开展对传统药方的科学验证,进行相关临床试验。例如台北市联合医院和阳明大学共同发现由党参、白术、茯苓、甘草等七味中药组成的中药复方“宽心饮”可改善肝功能异常的B肝患者病情,进而降低血清病毒量,将针对C型肝炎患者进行“宽心饮”改善肝功能异常的临床试验。义守大学为能够让传统治疗腹泻型肠躁症的药方“理中汤”获得科学验证,正在与“卫福部”合作推动临床试验。
由于中国大陆是中药最大市场,且也在积极发展中医药产业,已核准多项植物新药,因此吸引台湾从事中药研发的企业加紧布局大陆。例如泰宗生技公司已将治疗C型肝炎植物新药TCM-700C在中国大陆及东盟10国地区的权利金以人民币2.7亿元(约新台币14亿元)及新药上市营收的12%授予上海睿鉴生技公司,并将在台湾及大陆进行多中心三期临床试验合作。中天生技公司与合一生技公司也与大陆石药集团开展新药研发及市场销售方面的合作。



